jueves, 20 de noviembre de 2014
lunes, 17 de noviembre de 2014
Portal CCH
El oxígeno es el elemento más abundante en el planeta Tierra, constituye aproximadamente el 50% en masa de la corteza terrestre y forma el 21% en volumen de la atmósfera; es componente activo del aire, se encuentra presente en el agua y como óxidos con otros elementos. Reacciona tanto con metales como con no metales y, entre los no metales es el segundo en reactividad química, después del flúor.

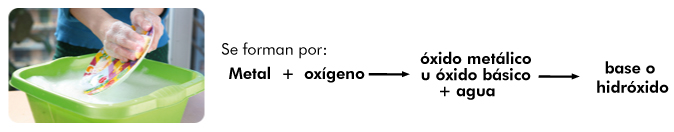
Después de la formación de los óxidos correspondientes tanto metálicos como no metálicos, es factible combinarlos con agua para formar nuevos compuestos. En el caso de los óxidos metálicos cuando interactúan con agua forman hidroxidos. Retomando el ejemplo del magnesio, se observa lo siguiente.El óxido de magnesio en presencia de agua forma el hidróxido de magnesio.
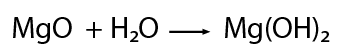
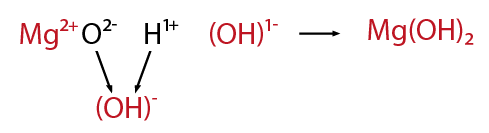
Los óxidos no metálicos en presencia de agua forman ácidos del tipo oxiacido.
La nomenclatura química es un conjunto de reglas que se aplican para nombrar y representar con símbolos y fórmulas a los elementos y compuestos químicos. Actualmente se aceptan tres sistemas de nomenclatura donde se agrupan y nombran a los compuestos inorgánicos:
- Sistema de nomenclatura estequimétrico ó sistemático de la Unión Internacional de Química Pura y Aplicada, (IUPAC).
- Sistema de nomenclatura funcional, clásico ó tradicional.
- Sistema de nomenclatura Stock.
Resultan de la combinación del oxígeno con metales y al reaccionar con el agua producen bases.
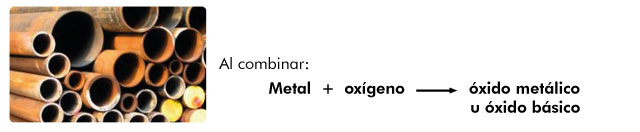
Se nombra con la palabra genérica óxido seguido de la preposición de enseguida el nombre del metal con el que se combinó,por ejemplo: óxido de calcio
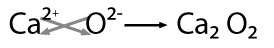
Nomenclatura clásica ó tradicional
Estos mismos compuestos se pueden nombrar con la palabra genérica óxidoseguida del nombre del metal con el sufijo oso para el valor menor de la valencia y con el sufijo ico cuando el valor de su valencia es mayor, por ejemplo:

Nomenclatura IUPAC
La IUPAC determina que estos compuestos se nombran a partir de la cantidad de elementos que los constituyen, por ejemplo:
NiO se nombra Monóxido de níquel y el Ni2O3 Trióxido de diníquel
Óxidos acidos
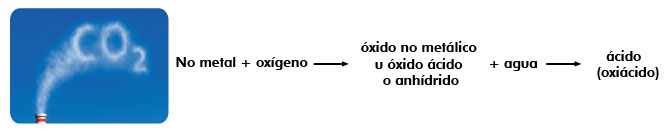
Son combinaciones del oxígeno con un no metal y al reaccionar con agua producen ácidos del tipo oxiácido.

Nomenclatura Stock
Se nombra con la palabra óxido seguida de la preposición de, a continuación el nombre del no metal expresando con número romano el valor de la valencia con la que interactuó con el oxígeno, por ejemplo:
Nomenclatura clásica ó tradicional
Este mismo tipo de compuestos, también se pueden nombrar con la palabra genérica anhídrido seguida del nombre del no metal con el sufijo oso para el valor de la menor valencia e ico para el valor de la mayor valencia, por ejemplo:

Cuando el no metal presenta más de dos valencias como es el caso del cloro se conservan los sufijos de la regla anterior y se utilizan además: el prefijo hipo proveniente del griego "hypo" que significa inferior o debajo, y el prefijo hiper o per del griego "hyper" que significa mayor o superior, por ejemplo:

Nomenclatura IUPAC
Este tipo de compuestos se nombran a partir de la cantidad de elementos que constituyan a su representación simbólica, empleando las raíces griegas de los números correspondientes, por ejemplo:
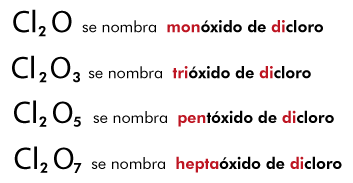
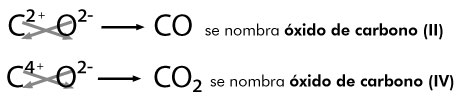
Dependiendo del número de valencias que presente el no metal, por ejemplo el carbono tiene dos valencias positivas 2+ y 4+, cuando actúa con el número de valencia 2+ al combinarse con el oxígeno 2-, se forma el monóxido de carbono, como se aprecia en la siguiente representación:

Cuando la combinación se lleva a cabo con la valencia 4+, resulta:

Hidroxidos
Una de las principales aplicaciones de las bases o hidróxidos es en la fabricación de los jabones que usamos a diario en casa.
¿Cómo se forman y nombran los hidróxidos?
Cuando se tiene un óxido no metálico, al combinarse con agua forma un ácido de tipo oxiácido, se llaman oxiácidos porque en su composición está presente el oxígeno y la calidad ácida será determinada por la presencia del hidrógeno.
Estos tipos de compuestos son los que producen la lluvia ácida, ya que son productos de desecho de la industria y de vehículos de combustión interna (automotores), debido a que se combinan con la humedad y agua del ambiente.
Este tipo de compuestos se forman con la combinación de un hidrógeno (H+) como ión positivo y un no metal (NM-) como ión negativo.

lunes, 13 de octubre de 2014
Modelos Atómicos
|
Modelos Atómicos
|
Dalton
|
Joseph Thomson
|
Ernest Rutherford
|
Niels Bohr
|
|
Teorías Postuladas
|
En 1808 un científico inglés John Dalton formulo
una definición de las unidades indivisibles con la que está formada la
materia y que llamamos átomos.
1 los elementos están formados por partículas
extremadamente pequeñas llamadas átomos.
2 todos los átomos de un mismo elemento son
idénticos, tiene igual tamaño, masa y propiedades químicas.
La teoría de Dalton explica la ley de las
propiedades múltiples de manera muy sencilla, diferentes compuestos formados
por el mismo elemento difieren en el número de átomos de cada clase.
|
En 1900 ya se conocían dos características de
los átomos que contienen electrones y que son eléctricamente neutros. Thomson
propuso que un atoo podría visualizarse como una esfera uniforme cargada
positivamente dentro de la cual se encontraban los electrones como si fueran
las pasas en un pastel.
Es posible extraer electrones de los átomos,
pero no del mismo modo ñas cargas positivas.
|
En 1910 un físico neerlandés Ernest
Rutherford utilizo partículas para demostrar la estructura de los átomos.
1 los átomos poseen el mismo número de
protones y electrones por tanto son entidades neutras
2 el núcleo, además, debe estar compuesto
por otros partículas con carga neutra para explicar la elevada masa del átomo
(superior a los esperado teniendo en cuenta solo el número de protones)
|
Los postulados de Bohr de explicar las
evidencias experimentales de los espectros atómicos a la luz de los
conocimientos que se tenían después en el micro mundo pero antes de la formalización
de la mecánica cuántica
1 un electrón en un átomo se mueve en una órbita
circular alrededor del núcleo, obedeciendo las leyes de la mecánica clásica.
2 un electrón que se mueva en una de esas
orbitas permitidas no irradia energía electromagnética aunque está siendo
acelerado constantemente por las fuerzas atractivas al núcleo. Por ello, su energía
total permanece constante
|
|
Evidencias Experimentales
|
Mientras investigaba la naturaleza de la
atmosfera en los primeros años del siglo XIX Dalton dedujo la estructura del dióxido
de carbono y propuso la teoría de que cada molécula está compuesta por un
numero definido de átomos. Postulo que todos los átomos de cualquier otro
elemento y los considero como esfera rígida e indestructible
|
Investigo si las cargas negativas de los
rayos catódicos podían ser separadas en un medio magnético. Para realizar
este experimento construyo un tubo de rayos catódicos en cuyos extremos
coloco dos ranuras que a su vez fueron conectadas a un electrómetro, comprobó
que cuando los rayos son desviados magnéticamente, se registra poca carga
|
Utilizo laminas muy delgadas de oro y de
otros metales, como blanco de partículas provenientes de una fuente
radiactiva, observo que la mayoría de las ´partículas atravesaban la lámina
sin desviarse, o bien con ligera desviación. De cuando en cuando algunas partículas
eran dispersadas o desviadas de su trayectoria hacia la fuente radiactiva.
|
Espectros de emisión
Desde el siglo XVIII demostró
Que la luz solar está formada de diversos componentes
de color que al volver a combinarlos producen luz blanca .En 1913 Bohr dio a conocer
una explicación teórica del espectro de emisión del átomo de hidrogeno. El tratamiento
de Bohr es muy complejo y no se considera correcto en toso sus detalles
|
sábado, 27 de septiembre de 2014
Practica 4
Tubos de ensaye.
Magnesio
Zinc
Pipeta Graduada
Pinzas para tubo de ensaye
Fuego
Reacciones:
Mg + O2 ---energia---> ¿?
CuSO + Zn ------> ¿?
Pb(NO3) + Kl -----> ¿?
Practica 3
Sintesis del Agua
11/09/14
lunes, 1 de septiembre de 2014
Practica 2
Acetona :
t T
0s 14°
15s 27°
30s 27°
43s 27°
60s 27°
75s 31°
Alcohol:
t T
490s 65°
520s 66°
550s 66°
580s 66°
610s 69°
Agua:
t T
850s 86°
880s 93°
910s 93°
940s 93°
950s 94°
miércoles, 27 de agosto de 2014
Practica 1
Objetivo: preparar 3 mezclas
a) Heterogénea 2 fases solidas una fase liquida (3 sustancias)
b) Homogénea fase liquida (3 sustancias)
c) Heterogénea 2 fases liquidas una fase solida
Información Bibliográfica:
Decantación: se emplea para separar una mezcla heterogénea formada por un liquido y un solido insoluble, en el es sedimentado los dos líquidos in-miscibles entre si (que no se disuelven)y que tienen diferente densidad.
Filtración: es un método para separar mezclas heterogéneas en la sen separa un solido insoluble en un liquido, haciéndolo por medio poroso llamado FILTRO, donde se aprovecha diferencia del tamaño de partícula, la cual va a ser retenida por el medio filtrante existen diferentes tipos de material filtrante, papel poroso o papel filtro.
Evaporación: es la eliminación de un liquido que se transforma en gas o se evapora,se utiliza para separar mezclas homogéneas formadas por un liquido y tiene un solido disuelto, se puede llevar a cabo en forma superficial cuando se calienta la mezcla hasta el punto de ebullición del liquido para acelerar su evaporación.
Hipótesis
En las mezclas heterogéneas las separamos por métodos de filtración y decantación para así obtener cada uno de los componentes que componen la mezcla.
En las mezclas homogéneas tenemos que usar el método de evaporación para separar los componentes (si es que hay un solido soluble).
Diseño Experimental:
materiales: mezcla 1 heterogénea ( frijoles,lentejas y agua)
mezcla 2 homogénea (azúcar, acetona y agua)
mezcla 3 heterogénea (arroz,aceite y agua )
Procedimientos:
Mezcla 1
En un vaso de precipitados agregamos frijoles, lentejas y agua, observamos y opinamos (los separamos por ,métodos de Filtración y Decantacion)
Mezcla 2
En un vaso de precipitados agregamos agua,azúcar y acetona revolvimos para obtener la mezcla homogénea (la separamos por el método de evaporación)
Mezcla 3
En un vaso de precipitados agregamos agua,arroz y aceite es menos denso que el agua y el arroz (lo separamos por método de filtración y después por el de decantación para separar el agua del aceite)
Observaciones
Observamos en la primera mezcla que era muy fácil distinguir sus componentes, conservan sus propiedades : mezcla heterogénea.
En la segunda observamos que no se podían distinguir bien sus componentes, solo se observa una sola fase.
En la tercera mezcla mezcla observamos tres fases con distintas densidades,se podía observar el aceite hasta en la parte de arriba y el arroz en la parte inferior.
Análisis
Todas las mezclas conservan sus propiedades ya que se separan por métodos físicos.
Conclusiones
pudimos observar que al hacer una mezcla ya sea homogénea o heterogénea podemos utilizar varios métodos de separación, en este caso fueron decantacion, filtración y evaporación y así sus componentes conservan sus propiedades.













































